2015 (10)
Catégories enfants
Protocole étude S.AGES : étude de cohorte du syndrome d’apnées obstructives au cours du sommeil (SAOS) des sujets âgés de plus de 70 ans, diagnostiqués dans les structures de pneumologie et de gériatrie
Écrit par Super UserObjectif principal
Décrire la population des patients atteints de SAOS âgés de 70 ans et plus, en France.
Objectifs secondaires
- Décrire la prise en charge diagnostique et thérapeutique de ces patients.
- Estimer la mortalité à 1,3 4, 5 ans des patients, les comparer avec les patients d’âge inférieur à 70 ans, selon les données de la littérature.
- Étudier l’observance et la tolérance des traitements.
- Étudier l’évolution des comorbidités, la survenue d’incidents et accidents évolutifs (pathologies respiratoires, cardiovasculaires, chutes, troubles cognitifs…).
Aspergillose bronchopulmonaire allergique : évaluation d’un traitement d’entretien par Ambisome® nébulisé
Écrit par Super UserÉtat des connaissances
L’aspergillose bronchopulmonaire allergique (ABPA) touche 3 à 13 % des patients atteints d’asthme. Son histoire naturelle comporte des exacerbations, pouvant menacer le pronostic vital et une évolution vers des troubles ventilatoires obstructifs fixés, voire des lésions de fibrose pulmonaire irréversibles. Le pronostic de l’ABPA est directement associé au contrôle des exacerbations et l’objectif principal du traitement est de diminuer la fréquence et la durée des exacerbations.
Étude de l’impact de la qualité du sommeil sur le sevrage de la ventilation mécanique
Écrit par Super UserObjectif :
L’objectif était d’évaluer l’impact de la qualité du sommeil sur la durée de sevrage ventilatoire en comparant la qualité du sommeil chez les patients avec un sevrage court (<3jours) versus prolongé (≥3jours).
Méthodes
Tous les patients intubés plus de 24heures et ayant échoué au premier test de sevrage étaient inclus. Les critères d’exclusion comprenaient : la poursuite de sédation, les pathologies neuromusculaires, du système nerveux central ou psychiatrique. Les explorations comprenaient une polysomnographie, les mesures de la force musculaire périphérique, pression inspiratoire maximale (PIM) et la recherche d’un syndrome confusionnel.
IRM du parenchyme pulmonaire : vers une application clinique ?
Écrit par Super UserLongtemps considérée comme le parent pauvre de l’imagerie par résonance magnétique (IRM) d’organe, l’IRM pulmonaire a bénéficié d’évolutions technologiques qui rendent aujourd’hui réaliste son utilisation. Néanmoins, si les développements technologiques ont permis de solutionner la plupart des difficultés techniques, la diversité et le florilège des séquences proposées nécessitent une synthèse des données, afin d’envisager des protocoles simples et un rationnel dans son utilisation.
Effect of Azithromycin on Airflow Decline–Free Survival After Allogeneic Hematopoietic Stem Cell Transplant
Importance
Bronchiolitis obliterans syndrome has been associated with increased morbidity and mortality after allogeneic hematopoietic stem cell transplant (HSCT). Previous studies have suggested that azithromycin may reduce the incidence of post–lung transplant bronchiolitis obliterans syndrome.
Titre
Nom et prénom de l’investigateur-coordinateur
 Drouot Xavier
Drouot XavierCHU Poitiers
Promoteur
Domaine de Recherche
Structure responsable de la gestion de projet
Encadrement/support scientifique INSERM CIC 1402 : Equipe Acute Lung lnjury and Ventilatory Support « AUVE »
Rationnel
Chez les patients intubés sous ventilation mécanique en réanimation, le temps consacré au sevrage du ventilateur représente près de la moitié du temps total de ventilation. Il a été montré qu'une durée de ventilation mécanique prolongée était associée à une mortalité excessive. La réduction de la durée de ventilation est un objectif majeur pour les réanimateurs. Il est fondamental d'identifier les causes d'échec de sevrage afin de limiter la durée du sevrage.
Le sevrage de la ventilation assistée nécessite la reprise d'une activité musculaire inspiratoire efficace, elle même dépendante d'une commande respiratoire cérébrale satisfaisante. Cette commande centrale est indispensable pour assurer une excitation optimale des neurones phréniques durant les premières minutes de respiration spontanée. Il a été montré qu'une atteinte de la commande inspiratoire centrale supraspinale compromet l'endurance des muscles inspiratoires.
De plus, il a été démontré que cette commande centrale est cruciale dans le maintien d'une réponse ventilatoire adaptée dans des expériences d'inspiration contre résistance chez le volontaire sain. Une défaillance de cette commande centrale (aussi dénommée «fatigue diaphragmatique centrale») est impliquée dans l'épuisement inspiratoire lors d'une tâche d'inspiration contre résistance.
La privation de sommeil est responsable d'altérations cognitivo-comportementales mais est également responsable d'une réduction des capacités d'endurance des muscles squelettiques.
Le sommeil est sévèrement altéré en unités de soins intensifs (USI). Chez beaucoup de patients, la quantité totale de sommeil est diminuée. La qualité est également anormale avec une fragmentation très importante, en partie due au bruit et à la luminosité des USI. Récemment, nous avons démontré que, plutôt que le scorage standard du sommeil, la mesure de la continuité du sommeil (estimée par le pourcentage du temps de sommeil passé dans des épisodes plus courts ou plus longs que 10 minutes) était un paramètre pertinent pour quantifier la qualité du sommeil des patients en USI (Drouot, sous presse).
Quelques études ont indiqué qu'une privation de sommeil altérait les capacités d'endurance inspiratoire chez des volontaires sains.
Originalité et Caractère Innovant
Certains experts suggèrent qu'une mauvaise qualité de sommeil pourrait être délétère sur le sevrage de la ventilation. Cependant, aucune étude à ce jour n'a évalué cette relation. Il a été clairement montré que le sevrage prolongé était associé à une mortalité significativement plus élevée en réanimation.
Si notre étude montre que la qualité du sommeil influence réellement la durée du sevrage des patients de réanimation, alors des mesures spécifiques devront être évaluées afin d'améliorer le pronostic de ces patients.
La mesure de la continuité du sommeil est tout à fait innovante dans l'exploration du sommeil : cette mesure postule que, chez le patient d'USI, 1 épisode de 24 minutes et 3 épisodes de 6 minutes seront plus restaurateurs que 3 épisodes de 8 minutes et un de 6 (temps de sommeil de 30 min et fragmentation équivalente dans les deux schémas).
Enfin, à l'heure actuelle, il n'existe pas d'étude polysomnographique longitudinale en USI médicale.
Objet de la Recherche
Objectif principal : Comparer la durée du sevrage des patients qui ont une mauvaise qualité de sommeil et de ceux qui ont une bonne qualité de sommeil.
Objectifs secondaires :
- Rechercher une corrélation entre la qualité du sommeil et l'amélioration de la fonction respiratoire (Pl max-P01 ).
- Rechercher une corrélation entre la qualité du sommeil et la survenue d'un syndrome confusionnel secondaire.
- Comparer l'évolution de la qualité du sommeil entre le moment de l'échec du sevrage (polysomnographie à l'inclusion) et la réussite du sevrage (polysomnographie de contrôle).
Critères d'évaluation secondaires (en lien avec les objectifs secondaires) :
- Corréler les paramètres de qualité du sommeil et l'amélioration de la fonction respiratoire : variation de la pression inspiratoire maximale et de la pression d'occlusion P01 avant et après la polysomnographie
- Comparer l'incidence du delirium entre les patients qui ont une mauvaise qualité de sommeil et ceux qui ont une bonne qualité de sommeil
- Comparer les paramètres de qualité du sommeil entre le moment de l'échec du sevrage (polysomnographie à l'inclusion) et la réussite du sevrage (polysomnographie de contrôle).
Population d'étude
Principaux critères d'inclusion :
- Durée de ventilation mécanique > 24h avant le premier test de sevrage
- Patients ayant un sevrage difficile, défini par l'échec du premier test de sevrage (conférence de consensus international sur le sevrage)
- Pathologies neuromusculaires périphériques ayant conduit à l'intubation (type myopathie ou myasthénie)
- Pathologies du système nerveux central (tumeur, Parkinson, SEP, épilepsie, AVC .... ) ou pathologie psychiatrique connue.
- Aggravation de l'état clinique avant la réalisation de la polysomnographie : survenue d'un état de choc nécessitant la mise sous vasopresseur, aggravation respiratoire avec Pa02/Fi02<1SO mm Hg, coma (Glasgow <8, d'origine non hypercapnique), nouvel événement neurologique central (AVC, hémorragie cérébrale, crise d'épilepsie)
- Nécessité d'une sédation en continu avant la réalisation de la polysomnographie
- Agitation empêchant la réalisation de la polysomnographie
- Refus du patient
Bénéfices attendus pour le patient et/ou pour la santé publique
L'influence de la qualité du sommeil sur le sevrage n'a jamais étudiée. Notre étude serait donc la première à évaluer cette relation et pourrait conduire à une publication internationale de bon niveau. Si la qualité du sommeil influence effectivement la durée du sevrage alors nous envisagerons une étude multicentrique afin de déterminer si des mesures de protection du sommeil pourraient réduire la durée de ventilation mécanique en réanimation.
Ce projet sera également conduit en partenariat avec l'équipe de Franco Laghi (Loyola University, Chicago, IL, USA) : Une aide sera apportée à cette équipe pour l'analyse des PSG et l'expérience de cette équipe dans l'analyse de la fonction diaphragmatique sera importée en France. Des séjours de chercheurs français aux USA et de chercheur américains en France sont prévus à brève échéance.
Cette collaboration Poitiers Chicago est une opportunité majeure pour notre équipe.
Mots Clés
Bibliographie
- Esteban A, Ferguson ND, Meade MO, Frutos-Vivar F, Apezteguia C, Brochard L, Raymondos K, Nin N, Hurtado J, Tomicic V, Gonzalez M, Elizalde J, Nightingale P, Abroug F, Pelosi P, Arabi Y, Moreno R, Jibaja M, D'Empaire G, Sandi F, Matamis D, Montanez AM, Anzueto A (2008) Evolution of mechanical ventilation in response to clinical research. Am J Respir Crit Care Med 177:170-177
- Ely EW, Baker AM, Dunagan DP, Burke HL, Smith AC, Kelly PT, Johnson MM, Browder RW, Bowton DL, Haponik EF (1996) Effect on the duration of mechanical ventilation of identifying patients capable of breathing spontaneously. N Engl J Med 335:1864-1869
- Girard TD, Kress JP, Fuchs BD, Thomason JW, Schweickert WD, Pun BT, Taichman DB, Dunn JG, Pohlman AS, Kinniry PA, Jackson JC, Canonico AE, Light RW, Shintani AK, Thompson JL, Gordon SM, Hall JB, Dittus RS, Bernard GR, Ely EW (2008) Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet 371:126-134
- Boles JM, Bion J, Connors A, Herridge M, Marsh B, Melot C, Pearl R, Silverman H, Stanchina M, Vieillard-Baron A, Welte T (2007) Weaning from mechanical ventilation. Eur Respir J 29:1033-1056
- Funk GC, Anders S, Breyer MK, Burghuber OC, Edelmann G, Heindl W, Hinterholzer G, Kohansal R, Schuster R, Schwarzmaier D, Assie A, Valentin A, Hartl S (2010) Incidence and outcome of weaning from mechanical ventilation according to new categories. Eur Respir J 35:88-94
- Sellares J, Ferrer M, Cano E, Loureiro H, Valencia M, Torres A (2011) Predictors of prolonged weaning and survival during ventilator weaning in a respiratory ICU. Intensive Care Med 37:775-784
- Tonnelier A, Tonnelier JM, Nowak E, Gut-Gobert C, Prat G, Renault A, Boles JM, L'Her E (2011) Clinical relevance of classification according to weaning difficulty. Respir Care 56:583-590
- Penuelas 0, Frutos-Vivar F, Fernandez c, Anzueto A, Epstein SK, Apezteguia C, Gonzalez M, Nin N, Raymondos K, Tomicic V, Desmery P, Arabi Y, Pelosi P, Kuiper M, Jibaja M, Matamis D, Ferguson ND, Esteban A (2011) Characteristics and outcomes of ventilated patients according to time to liberation from mechanical ventilation. Am J Respir Crit Care Med 184:430-437
- Lemaire F, Teboul JL, Cinotti L, Giotto G, Abrouk F, Steg G, Macquin-Mavier 1, Zapol WM (1988) Acute left ventricular dysfunction during unsuccessful weaning from mechanical ventilation. Anesthesiology 69:171-179
- Cabello B, Thille AW, Roche-Campo F, Brochard L, Gomez FJ, Mancebo J (2010) Physiological comparison of three spontaneous breathing trials in difficult-to-wean patients. Intensive Care Med 36:1171-1179
- Caille V, Amiel JB, Charron C, Belliard G, Vieillard-Baron A, Vignon P (2010) Echocardiography: a help in the weaning process. Crit Care 14:R120
- Jubran A, Tobin MJ (1997) Pathophysiologic basis of acute respiratory distress in patients who fail a trial of weaning from mechanical ventilation. Am J Respir Crit Ca re Med 155:906-915
- Jubran A, Mathru M, Dries D, Tobin MJ (1998) Continuous recordings of mixed venous oxygen saturation during weaning from mechanical ventilation and the ramifications thereof. Am J Respir Crit Care Med 158:1763-1769
- Levine S, Nguyen T, Taylor N, Friscia ME, Budak MT, Rothenberg P, Zhu J, Sachdeva R, Sonnad S, Kaiser LR, Rubinstein NA, Powers SK, Shrager JB (2008) Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med 358:1327-1335
- Jaber S, Petrof BJ, Jung B, Chanques G, Berthet JP, Rabuel C, Bouyabrine H, Courouble P, Koechlin-Ramonatxo C, Sebbane M, Similowski T, Scheuermann V, Mebazaa A, Capdevila X, Mornet D, Mercier J, Lacampagne A, Philips A, Matecki S (2011) Rapidly progressive diaphragmatic weakness and injury during mechanical ventilation in humans. Am J Respir Crit Care Med 183:364-371
- De Jonghe B, Sharshar T, Lefaucheur JP, Authier FJ, Durand-Zaleski 1, Boussarsar M, Cerf C, Renaud E, Mesrati F, Carlet J, Raphael JC, Outin H, Bastuji-Garin S (2002) Paresis acquired in the intensive care unit: a prospective multicenter study. Jama 288:2859-2867
- De Jonghe B, Bastuji-Garin S, Durand MC, Malissin 1, Rodrigues P, Cerf C, Outin H, Sharshar T (2007) Respiratory weakness is associated with limb weakness and delayed weaning in critical illness. Crit Care Med 35:2007-2015
- De Jonghe B, Bastuji-Garin S, Sharshar T, Outin H, Brochard L (2004) Does ICU-acquired paresis lengthen weaning from mechanical ventilation? Intensive Care Med 30:1117-1121
- Garnacho-Montero J, Amaya-Villar R, Garcia-Garmendia JL, Madrazo-Osuna J, Ortiz-Leyba C (2005) Effect of critical illness polyneuropathy on the withdrawal from mechanical ventilation and the length of stay in septic patients. Crit Care Med 33:349-354
- Sharshar T, Bastuji-Garin S, Stevens RD, Durand MC, Malissin 1, Rodriguez P, Cerf C, Outin H, De Jonghe B (2009) Presence and severity of intensive care unit-acquired paresis at time of awakening are associated with increased intensive care unit and hospital mortality. Crit Care Med 37:3047-3053
- Beecroft JM, Ward M, Younes M, Crombach S, Smith 0, Hanly P (2008) Sleep monitoring in the ICU: comparison of nurse assessment, actigraphy and polysomnography. Intensive Care Medicine 34:2076-2083
- Cooper AB, Thornley KS, Young GB, Slutsky AS, Stewart TE, Hanly PJ (2000) Sleep in critically ill patients requiring mechanical ventilation. Chest 117:809-818
- Freedman NS, Gazendam J, Levan L, Pack Al, Schwab RJ (2001) Abnormal sleep/wake cycles and the effect of environmental noise on sleep disruption in the intensive care unit. Am J Respir Crit Care Med 163:451-457
- Gabor JY, Cooper AB, Crombach SA, Lee B, Kadikar N, Bettger HE, Hanly PJ (2003) Contribution of the intensive care unit environment to sleep disruption in mechanically ventilated patients and healthy subjects. Am J Respir Crit Care Med 167:708-715
- Cabello B, Thille AW, Drouot X, Galia F, Mancebo J, D'Ortho M, Brochard L (2006) Sleep quality in mechanical ventilated patients: comparison of three ventilatory modes. Intensive Care Medicine 32:S250,0966
- Roche Campo F, Drouot X, Thille AW, Galia F, Cabello B, d'Ortho MP, Brochard L (2010) Poor sleep quality is associated with late noninvasive ventilation failure in patients with acute hypercapnie respiratory failure. Crit Care Med 38:477-485
- Roche-Campo F, Thille AW, Drouot X, Galia F, Margarit L, Cordoba-lzquierdo A, Mancebo J, d'Ortho MP, Brochard L (2013) Comparison of sleep quality with mechanical versus spontaneous ventilation during weaning of critically Ill tracheostomized patients. Crit Care Med 41:1637-1644
- Cordoba-lzquierdo A, Drouot X, Thille AW, Galia F, Roche-Campo F, Schortgen F, Prats-Soro E, Brochard L (2013) Sleep in hypercapnie critical care patients under noninvasive ventilation: conventional versus dedicated ventilators. Crit Care Med 41:60-68
- Drouot X, Roche-Campo F, Thille AW, Cabello B, Galia F, Margarit L, d'Ortho MP, Brochard L (2012) A new classification for sleep analysis in critically ill patients. Sleep Med 13:7-14
- Ely EW, Shintani A, Truman B, Speroff T, Gordon SM, Harrell FE, Jr., lnouye SK, Bernard GR, Dittus RS (2004) Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. Jama 291:1753-1762
- Martin BJ, Gaddis GM (1981) Exercise after sleep deprivation. Med Sei Sports Exerc 13:220-223
- Cooper KR, Phillips BA (1982) Effect of short-term sleep loss on breathing. J Appl Physiol 53:855-858
- Schiffman PL, Trontell MC, Mazar MF, Edelman NH (1983) Sleep deprivation decreases ventilatory response to C02 but not load compensation. Chest 84:695-698
- White DP, Douglas NJ, Pickett CK, Zwillich CW, Weil JV (1983) Sleep deprivation and the control of ventilation. Am Rev Respir Dis 128:984-986
- Chen Hl, Tang YR (1989) Sleep loss impairs inspiratory muscle endurance. Am Rev Respir Dis 140:907-909
- (1992) EEG arousals: scoring rules and examples: a preliminary report from the Sleep Disorders Atlas Task Force of the American Sleep Disorders Association. Sleep 15:173-184
- Plaschke K, von Haken R, Scholz M, Engelhardt R, Brobeil A, Martin E, Weigand MA (2008) Comparison of the confusion assessment method for the intensive care unit (CAM-ICU) with the Intensive Care Delirium Screening Checklist (ICDSC) for delirium in critical care patients gives high agreement rate(s). Intensive Care Med 34:431-436
- van Eijk MM, van Marum RJ, Klijn lA, de Wit N, Kesecioglu J, Slooter AJ (2009) Comparison of delirium assessment tools in a mixed intensive care unit. Crit Care Med 37:1881-1885
- Gusmao-Fiores D, Salluh JI, Chalhub RA, Quarantini LC (2012) The Confusion Assessment Method for the Intensive Ca re Unit (CAM-ICU) and Intensive Care Delirium Screening Checklist (ICDSC) for the diagnosis of delirium: a systematic review and metaanalysis of clinical studies. Crit Ca re 16:R115
- Bergeron N, Dubois MJ, Dumont M, Dial S, Skrobik Y (2001) Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med 27:859-864
Titre
Etude S.AGES. Recueil et suivi de nouveaux cas de syndromes d’apnées obstructives au cours du sommeil (SAOS), chez des sujets âgés de plus de 70 ans, diagnostiqués dans les structures de pneumologie et de gériatrie.
Acronyme : S.AGES
Nom et prénom de l’investigateur-coordinateur

Vice- Président du Collège des Pneumologues des Hôpitaux généraux (CPHG),
La Maison du Poumon, 66 boulevard Saint Michel, 75006 Paris
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Promoteur
Institut de Recherche en Santé Respiratoire des Pays de Loire
9 rue du Landreau BP 77132 49071 Beaucouzé CedexPrésident : Pr Jean Louis RACINEUX
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Domaine de Recherche
Structure responsable de la gestion de projet
(IRSR-CPL), et Collège des Pneumologues des Hôpitaux généraux (CPHG)
Rationnel
Les objectifs secondaires :
- Décrire la prise en charge diagnostique et thérapeutique de ces patients .
- Estimer la mortalité après 1,3 4 5 ... ans, comparativement à des patients de moins de 70 ans, selon les données de la littérature
- Examiner la conformité et la tolérance des traitements.
- Etudier l’évolution des comorbidités, des incidents et des accidents évolutifs (maladies respiratoires, maladies cardio-vasculaires, chutes, troubles cognitifs ...).
Population de l'étude : sont inclus dans l'étude tous les patients adultes (> ou = 70 ans) souffrant de SAOS diagnostiqués par polysomnographie ou polygraphie ventilatoire , suivis par un pneumologue ou un gériatre , après avoir été informés des objectifs de l'étude , et ayant donné leur consentement écrit.
Conception de l'étude : S.AGES comprend plusieurs périodes : la constitution progressive de la cohorte et la collecte de données à l'inclusion (information initiale et visite 1), puis la collecte d'informations à chaque visite ultérieure.
Pour chaque patient un e-crf sera rempli de façon exhaustive en ligne via le site dédié (IRSR, Institut de Recherche en Santé Respiratoire des Pays de la Loire).
Originalité et Caractère Innovant
Le sous diagnostic est important chez les sujets âgés. Il y a de plus une méconnaissance des particularités gériatriques de la maladie, et des préjugés en matière de diagnostic et de traitement, on parle ainsi parfois d' « inutilité » !
Objet de la Recherche
Objectifs secondaires :
- Décrire la prise en charge diagnostique et thérapeutique de ces patients.
- Estimer la mortalité à 1,3 4, 5 …ans des patients, les comparer avec les patients d'âge inférieur à 70 ans, selon les données de la littérature (une publication de Lavie 2009 montre que les patients de plus de 65 ans avec un syndrome d’apnées du sommeil modéré ont une mortalité inférieure à celle de sujets de plus de 65 ans sans SAOS), et en chercher les facteurs de risque.
- Etudier l’observance et la tolérance des traitements,
- Etudier l’évolution des comorbidités, la survenue d’incidents et accidents évolutifs (pathologies respiratoires, cardio-vasculaires, chutes, troubles cognitifs…),
S.AGES comprend plusieurs périodes: la constitution progressive de la cohorte et le recueil des données à l’inclusion (informations initiales et visite N°1), puis le recueil des informations lors de chaque visite ultérieure.
Les médecins investigateurs recenseront tous les patients répondant aux critères d’inclusion de l’étude et rempliront pour chaque patient les fiches en ligne via le site dédié. Tous les items devront être impérativement renseignés par les investigateurs qui s’engagent à un recueil exhaustif des données pour chaque patient inclus.Données recueillies à l’inclusion :
La fiche d’identification et de recueil d’informations initiales permet de faciliter le suivi du statut vital du patient. Les données recueillies sont le nom (y compris le nom de jeune fille pour les femmes mariées), le prénom, la date de naissance du patient, le nom et le code postal de sa commune de naissance, son adresse et son numéro de téléphone, …Les données à recueillir à l’inclusion sur les fiches questionnaires « visite N°1 » portent sur le patient, son statut clinique, ses comorbidités…, le SAOS, et la stratégie thérapeutique de 1ère intention.Critères d'évaluation secondaires (en lien avec les objectifs secondaires) : Saisie des données de suivi. Elle se fait sur les fiches de « Visite N°2 » et suivantes.
Population d'étude
- Seront inclus dans l’étude tous les patients adultes d’âge supérieur à 70 ans,
- ayant une polygraphie ventilatoire ou une polysomnographie,
- pour recherche de troubles respiratoires au cours du sommeil,
- suivis par un pneumologue, ou un gériatre,
- ayant été informés (par la remise d’une fiche d’information) des objectifs de l’étude,
- et ayant donné leur accord par écrit.
Principaux critères d’exclusion : Sujets incapables de donner leur consentement (troubles des fonctions supérieures, tutelle ou curatelle…)
Bénéfices attendus pour le patient et/ou pour la santé publique
Cette étude va permettre :
- la constitution d'une importante cohorte prospective,
- une analyse des données démographiques, morphologiques, et symptomatiques (somnolence diurne excessive,
- évaluation gériatrique minimale, échelles de fatigue, de dépression, dépendance…), des comorbidités (cardiovasculaires, métaboliques, neurocognitives…), des modalités et des données diagnostiques, des prises en charge thérapeutiques.
- Un suivi progressif et régulier de la cohorte : observance et tolérance des traitements, évolution des comorbidités, survenue d’incidents et accidents évolutifs (pathologies respiratoires, cardio-vasculaires, chutes, troubles cognitifs…), mortalité.
Mots Clés
Bibliographie
- Ancoli-Israel S, Kripke DF, Klauber MR, Mason WJ, Fell R, Kaplan O. Sleep disordered breathing in community-dwelling elderly. Sleep 1991;14:486-95.
- Babak Mokhlesi, Sushmita Pamidi,H. Klar Yaggi. Sleep Disordered Breathing and Subjective Sleepiness in the Elderly: A Deadly Combination? Commentary on Gooneratne et al. Sleep disordered breathing with excessive daytime sleepiness is a risk factor for mortality in older adults. Sleep 2011; 34:435-442.
- Krieger J, Sforza E, Boudewijns A, Zamagni M, Petiau C. Respiratory effort during obstructive sleep apnea. Role of age and sleep state. Chest 1997; 112: 875-84.
- Launois SH, Pepin JL, Levy P. Sleep apnea in the elderly: a specific entity? Sleep Med Review 2007; 11:87-97.
- Sforza E, Roche R, Thomas-Anterion C, Kerleroux J, Beauchet O, Celle S, Maudoux D, Pichot V, Laurent B, Barthélémy JC. Cognitive Function and Sleep Related Breathing Disorders in a Healthy Elderly Population: the Synapse Study. Sleep 2010 ; 33(4): 515-21
Titre
Evaluation d’une stratégie thérapeutique comprenant de L’AMBISOME® nébulisé en traitement d’entretien dans l’aspergillose broncho-pulmonaire allergique (mucoviscidose exclue).
Acronyme : NEBULAMB
Nom et prénom de l’investigateur-coordinateur
 Cendrine GODET
Cendrine GODETServices des Maladies Infectieuses
CHU Poitiers
86021 POITIERS cedex
Promoteur
Domaine de Recherche
Structure responsable de la gestion de projet
CHU Poitiers
86021 POITIERS cedex
Rationnel
L’aspergillose bronchopulmonaire allergique (ABPA) touche 3 à 13% des patients atteints d’asthme. Son histoire naturelle comporte des exacerbations, pouvant menacer le pronostic vital et une évolution vers des troubles ventilatoires obstructifs fixés voire des lésions de fibrose pulmonaire irréversibles associées à des complications de type hypertension artérielle pulmonaire. Le pronostic de l’ABPA est directement associé au contrôle des exacerbations et l’objectif principal du traitement est de diminuer la fréquence et la durée des exacerbations.
Les recommandations sont peu précises concernant les posologies et les durées de traitement dans l’ABPA et reposent sur deux essais prospectifs de faible puissance. Le traitement actuellement utilisé associant itraconazole et corticothérapie comporte de nombreuses limites : effets secondaires, interactions médicamenteuses et risque potentiel d’évolution vers des formes de passage invasive de l’aspergillose. L’itraconazole au-delà d’une faible biodisponibilité expose tout comme les autres triazolés (voriconazole et posaconazole) à des risques fréquents et potentiellement sévères d’effets secondaires pouvant s’élever à 55%.
De plus, l’exposition répétée aux triazolés, expose à un risque croissant d’émergence de souches d’Aspergillus de sensibilité diminuée ou résistantes pouvant être à l’origine d’échecs thérapeutiques.
Dans ce contexte nous proposons d’évaluer le bénéfice potentiel sur le contrôle des exacerbations d’un traitement d’entretien succédant à un traitement d’attaque dans le cadre d’une étude randomisée prospective multicentrique.
Intérêts de la stratégie évaluée dans l’étude
L’intérêt de la nébulisation de l’Amphotéricine B liposomale (LAmB) est d’obtenir des concentrations in situ élevées, alors qu’il existe une distribution hétérogène des antifongiques administrés par voie systémique. Elle permet de s’affranchir des interactions médicamenteuses et de diminuer les toxicités potentielles des antifongiques systémiques, en raison de l'absence de passage plasmatique. Enfin, cette stratégie permet de limiter l’émergence de souches résistantes aux azolés.
L’efficacité et la bonne tolérance de LAmB, y compris à long terme (absence de dépôts lipidiques prouvé sur suivi prolongé par biopsies), a été largement décrite chez les patients transplantés et neutropéniques, et fait l’objet de recommandations (ECIL) dans la prophylaxie des infections fongiques dans certaines populations d’hématologie.Originalité et Caractère Innovant
Nouvelle stratégie de prise en charge thérapeutique de l’ABPA par un traitement nébulisé utilisant une molécule antifongique fongicide en traitement d’entretien.
Les résultats attendus sont une amélioration de la prise en charge des patients traités pour ABPA, se traduisant par une diminution de la fréquence et de la durée des exacerbations, une optimisation du contrôle de la maladie asthmatique et une amélioration de la qualité de vie des patients.
Dans tous les cas, les résultats permettront de guider les praticiens dans la conduite des traitements de l’ABPA en définissant mieux la place des aérosols d’ambisome® sur des critères d’«evidence base medicine».
Un point important justifiant une telle étude est l’impact médico-économique de cette nouvelle stratégie thérapeutique, qui se traduit par une diminution du recours aux soins pour des symptômes respiratoires aigus. Différents travaux (D. Denning) montrent que le rapport coût/efficacité est en faveur d’un traitement antifongique d’entretien prolongé (voriconazole ou posaconazole pendant 6 à 12 mois), dans la prise en charge des ABPA en raison d’un meilleur contrôle de la maladie asthmatique se traduisant ainsi par une diminution importante des coûts d’hospitalisation. Cependant les traitements systémiques sus-cités utilisés de manière prolongée comportent encore un taux élevé d’effets indésirables et d’échecs thérapeutiques en raison de l’émergence de résistances. Par ailleurs, en France, dans une perspective de limitation du recours à l’itraconazole, le chiffrage du coût de revient d’une stratégie thérapeutique comportant des traitements antifongiques sur 6 mois est largement à l’avantage de l’amphotéricine B liposomale : amphotéricine B liposomale par voie nébulisée : 4080 € (actes infirmiers inclus), voriconazole : 15120 €, posaconazole : 23990 €.
Objet de la Recherche
Objectif principal :
Objectifs secondaires :
-
Evaluer la tolérance des aérosols de LAmB,
-
Comparer entre les deux stratégies le nombre d’exacerbations cliniques sévères par patient,
- Comparer entre les deux stratégies l’incidence d’une aggravation de la symptomatologie clinique,
- Comparer entre les deux stratégies le nombre de consultations et d’hospitalisations pour des symptômes respiratoires entre M4 et M28,
- Comparer entre les deux stratégies la dose cumulée de corticoïdes systémiques et inhalés entre M4 et M28,
- Evaluer la concordance entre l’évolution de la symptomatologie clinique et les variations du taux des IgE totales ainsi que l’évolution des paramètres radiologiques
Critère de jugement principal :
Le critère de jugement principal est la survenue d’une exacerbation clinique sévère dans les 24 mois suivant le traitement d’attaque, définie par l’apparition ou l’aggravation d’une dyspnée par rapport à l’état de base ayant justifié :
Seule la première exacerbation clinique survenant chez un patient sera considérée pour ce critère principal.
Critères de jugement secondaires :
Population d'étude
Critères d’inclusion :
- terrain atopique ou antécédents d’asthme dans les 2 ans,
- antécédents d’IgE totales >417 KU/L (ou > 210 KU/L avec une aggravation évidente d’une ABPA connue), d’IgE spécifiques envers Aspergillus fumigatus positifs ou tests cutanés positifs en lecture immédiate.
- associés à 2 autres des critères suivants : documentation d’anticorps précipitants ou d’IgG positifs envers Aspergillus fumigatus, d’infiltrats radiologiques liés à une ABPA (transitoires / persistants / dilatations bronchiques), éosinophilie sanguine > 500 éléments/mm3.
Critères d’exclusion :
- Patient atteint de mucoviscidose
- Patient présentant une contre-indication à l’itraconazole
- Intolérance aux β2-mimétiques
- Antécédents d’hypersensibilité à l’amphotéricine B liposomale ou à tout autre constituant
- Patient traité par anticorps monoclonal anti-IgE depuis moins de quatre mois ou ayant présenté des complications liées à un précédent traitement par anticorps monoclonal anti-IgE
- Patient traité par aérosol d'Ambisome® depuis moins d'un mois ou ayant présenté des complications liées à un précédent traitement par aérosol d'Ambisome®
- Insuffisance rénale
- Insuffisance hépatique
- Anomalie significative de la numération-plaquettaire sanguine
- Utilisation concomitante d’un ou plusieurs traitements suivants : rifampicine, rifabutine, l'halofantrine, la mizolastine, le cisapride, la simvastatine, l'atorvastatine, le pimozide, le bépridil, le sertindole, Sultopride, terfenadine, astemizole, quinidine, carbamazepine, phenobarbital, ergotamine et dihydroergotamine, triazolam, sirolimus, ritonavir, efavirenz, phénitoïne, vardénafil (chez homme de plus de 75 ans).
- Dysfonction ventriculaire démontrée telle qu'une insuffisance cardiaque congestive ou des antécédents d'insuffisance cardiaque congestive
- Aspergillomes, aspergillose pulmonaire chronique, aspergillose pulmonaire invasive
- Infection respiratoire aggravant l’asthme ou l’ABPA
- Refus de participer à l’étude
Bénéfices attendus pour le patient et/ou pour la santé publique
Les pathologies broncho-pulmonaires liées à l’Aspergillus telles que l’ABPA ont été peu étudiées, notamment dans le suivi à moyen terme ou dans l’évaluation de leur progression (fréquence des exacerbations, réponse thérapeutique et durée de traitement dans l’ABPA) a fortiori de manière prospective et il reste de nombreuses incertitudes concernant les thérapeutiques ou stratégies les plus optimales.
Ainsi dans l’ABPA, une étude randomisée, contrôlée est nécessaire pour montrer le bénéfice potentiel dans le contrôle des exacerbations d’un traitement d’entretien succédant à un traitement d’attaque.L’évaluation de cette nouvelle stratégie thérapeutique répond à l’opportunité de fédérer des moyens de recherche autour de cette pathologie, à la nécessité relevée par plusieurs auteurs de suivre l’évolution de cette maladie et de déterminer le schéma thérapeutique le plus optimal.
Par ailleurs, un autre point important justifiant un tel schéma d’étude est l’impact médico-économique de cette nouvelle stratégie thérapeutique, se traduisant par une diminution du recours aux soins (passage en service d’urgence, hospitalisation en pneumologie, en soins intensifs ou en réanimation) pour des symptômes respiratoires aigus.Différents travaux ont en effet rapporté que les exacerbations demeurent un motif fréquent de consultation aux urgences, voire d’hospitalisation, ce qui traduit le plus souvent une prise en charge et un traitement de fond insuffisants.
Plus précisément, l’étude récente de D. Denning montre que le rapport coût/efficacité est en faveur d’un traitement antifongique d’entretien prolongée (voriconazole ou posaconazole pendant 6 à 12 mois), dans la prise en charge des ABPA en raison d’un meilleur contrôle de la maladie asthmatique se traduisant ainsi par une diminution importante des coûts d’hospitalisation, réduction de 50% à 90% (Chishimba 2012, Lai 2011). Cependant ces traitements utilisés de manière prolongée comporte encore un taux élevé d’effets indésirables et d’échecs thérapeutiques en raison de l’émergence de résistances.
De plus en France, dans une perspective de limitation du recours à l’itraconazole, le chiffrage du coût de revient d’une stratégie thérapeutique comportant des traitements antifongiques sur 6 mois est largement à l’avantage de l’Ambisome®: Ambisome®, 4080 € (actes infirmiers inclus), Vfend®, 15120 €, Noxafil® 23990 €.
Mots Clés
Bibliographie
- Agarwal R, Gupta D, Aggarwal AN, Behera D, Jindal SK Allergic bronchopulmonary aspergillosis: lessons from 126 patients attending a chest clinic in north India. Chest. 2006 Aug;130(2):442-8
- Agarwal R, Singh N, Gupta D. Pulmonary hypertension as a presenting manifestation of allergic bronchopulmonary aspergillosis.Indian J Chest Dis Allied Sci. 2009 Jan-Mar;51(1):37-40.
- Agarwal R, Aggarwal AN, Gupta D, Jindal SK. Aspergillus hypersensitivity and allergic bronchopulmonary aspergillosis in patients with bronchial asthma: systematic review and meta-analysis.Int J Tuberc Lung Dis. 2009 Aug;13(8):936-44
- Agarwal R, Aggarwal AN, Gupta N, Gupta D. A rare cause of acute respiratory failure--allergic bronchopulmonary aspergillosis. Mycoses. 2011 Jul;54(4):e223-7. doi: 10.1111/j.1439-0507.2009.01830.x. Epub 2009 Dec 21.
- Bains SN, Judson MA. Allergic bronchopulmonary aspergillosis. Clin Chest Med. 2012 Jun;33(2):265-81
- Bandrés Gimeno R, Muñoz Martínez MJ. Prolonged therapeutic response to voriconazole in a case of allergic bronchopulmonary aspergillosis. Arch Bronconeumol. 2007 Jan;43(1):49-51
- Burgel PR, Baixench MT, Amsellem M, Audureau E, Chapron J, Kanaan R, Honoré I, Dupouy-Camet J, Dusser D, Klaassen CH, Meis JF, Hubert D, Paugam A. High prevalence of azole-resistant Aspergillus fumigatus in adults with cystic fibrosis exposed to itraconazole. Antimicrob Agents Chemother. 2012 Feb;56(2):869-74
- Cadranel J, Philippe B, Hennequin C, Bergeron A, Bergot E, Bourdin A, Cottin V, Jeanfaivre T, Godet C, Pineau M, Germaud P. Voriconazole for chronic pulmonary aspergillosis: a prospective multicenter trial. Eur J Clin Microbiol Infect Dis. Received: 28 March 2012 / Accepted: 21 June 2012
- Camuset J, Nunes H, Dombret MC, Bergeron A, Henno P, Philippe B, Dauriat G, Mangiapan G, Rabbat A, Cadranel J. Treatment of chronic pulmonary aspergillosis by voriconazole in nonimmunocompromised patients. Chest. 2007 ;31 :1435-41
- Casey P, Garrett J, Eaton T.Allergic bronchopulmonary aspergillosis in a lung transplant patient successfully treated with nebulized amphotericin. J Heart Lung Transplant. 2002 Nov;21(11):1237-41.
- Chen, J C Surgical treatment for pulmonary aspergilloma: a 28 year experience. Thorax. 1997;52:9 810-813
- Chishimba L, Niven RM, Cooley J, Denning DW. Voriconazole and posaconazole improve asthma severity in allergic bronchopulmonary aspergillosis and severe asthma with fungal sensitization. J Asthma. 2012 May;49(4):423-33. doi: 10.3109/02770903.2012.662568. Epub 2012 Mar 2.
- Cornillet A, Camus C, Nimubona S, Gandemer V, Tattevin P, Belleguic C, Chevrier S, Meunier C, Lebert C, Aupée M, Caulet-Maugendre S, Faucheux M, Lelong B, Leray E, Guiguen C, Gangneux JP. Comparison of Epidemiological, Clinical, and Biological Features of Invasive Aspergillosis in Neutropenic and Nonneutropenic Patients: A 6-Year Survey. C I D 2006;43:577–584.
- Denning DW, Riniotis K, Dobrashian R, Sambatakou H.. Chronic cavitary and fibrosing pulmonary and pleural aspergillosis: case series, proposed nomenclature change, and review. Clin Infect Dis. 2003 Oct 1;37 Suppl 3:S265-80
- Diot P, Rivoire B, Le Pape A, Lemarie E, Dire D, Furet Y, Breteau M, Smaldone GC. Deposition of amphotericin B aerosols in pulmonary aspergillome. Eur Respir J. 1995 Aug;8(8):1263-8.
Titre
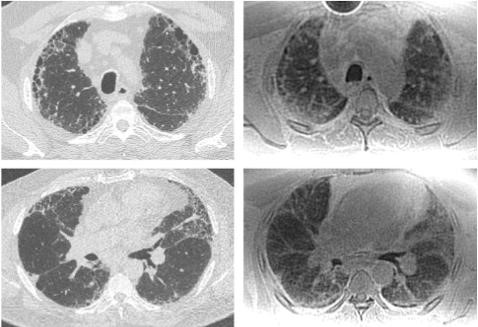
Evaluation des performances diagnostiques de l’IRM à haute résolution pour le diagnostic des pneumopathies interstitielles pulmonaires
Acronyme : PID-MRNom et prénom de l’investigateur-coordinateur
 Dr Gaël Dournes
Dr Gaël DournesPromoteur
Domaine de Recherche
Structure responsable de la gestion de projet
Rationnel
La tomodensitométrie (TDM) est l’examen de choix pour l’évaluation des pathologies interstitielles pulmonaires du fait de son excellente résolution spatiale et du bon contraste obtenu entre l’air et l’interstitium pulmonaire.
L’IRM souffre de difficultés inhérentes à son principe physique technique, du fait de la très faible teneur en proton du poumon qui est essentiellement composé d’air et d’interfaces air/tissu qui artéfactent l’image en IRM. Jusqu’ici les séquences d’IRM proposées offrent des résultats inferieurs au scanner dans le champ des maladies infiltratives diffuses du poumon. Pourtant, l’IRM est une modalité d’imagerie non-irradiante et, aujourd’hui, des publications ont montré qu’un excès de risque de cancer chez les sujets jeunes était associé aux irradiations répétées et cumulées au cours du temps avec la répétition des examens TDM chez les patients porteurs de pathologies chroniques (1,2).
Les images sont acquises en 10 minutes environ en respiration libre et sans injection de produit de contraste, avec une synchronisation respiratoire.
Originalité et Caractère Innovant
PETRA est une séquence qui permet d’imager le poumon à haute résolution spatiale, sans irradiation ni injection de produit de contraste.
Objet de la Recherche
Objectif principal : Evaluation des performances de la séquence PETRA pour le diagnostic de pathologie interstitielle pulmonaire en IRM poumon haute résolution
Objectifs secondaires :
- Evaluation de la séquence PETRA en IRM pour la caractérisation des types de pathologies interstitielles pulmonaires: fibrose de type UIP (Usual Interstitial Pneumoniae) ou NSIP (Non Specific Interstitial Pneumoniae), asbestose, sarcoidose micronodulaire, proteinose alveolaire
- Evaluation de la séquence PETRA en IRM dans la caractérisation des lésions associées aux pneumopathies interstitielles : rayon de miel, réticulation intra-lobulaire, verre dépoli, distortion architecturale, épaississements septaux, micronodules, crazy-paving
- Evaluation de la reproductibilité intra et inter-observateur des analyses IRM et TDM du parenchyme pulmonaire
Critère d’évaluation principal :
Performances diagnostiques de la séquence PETRA en IRM pour le diagnostic de pneumopathie interstitielle (sensibilité, spécificité, valeur prédictive positive, valeur prédictive négative) versus celles du TDM considéré comme gold standardCritère d’évaluation secondaires :
- comparaison de la séquence PETRA et du TDM (gold standard) pour la caractérisation du pattern principaux des principaux types de pathologies interstitielles: Pneumonie interstitielle commune (PIC), Pneumonie interstitielle non spécifique (PINS), Sarcoidose, pneumonie d’hypersensibilité
- comparaison de la séquence PETRA et du TDM (gold standard) pour caractériser les lésions de pneumopathie interstitielle : rayon de miel, réticulation intra-lobulaire, verre dépoli, distortion architecturale, épaississements septaux, micronodules, et leur profusion dans le poumon
- étude de la reproductibilité intra et inter-observateur des analyses (test du kappa, coefficient de corrélation de Pearson, analyse de Bland-Altman)
Population d’étude
Principaux critères d’inclusion:
- Age > 20 ans
- Diagnostic de pneumopathie interstitielle documenté par en clinique, exploration fonctionnelle respiratoire (EFR) et tomodensitométrie
- EFR, tomodensitométrie et IRM le même jour
Principaux critères d’exclusion:
- Contre-indication à l’IRM: claustrophobie, pile cardiaque non compatible à l’IRM, matériel ferromagnétique non compatible à l’IRM
- Délai entre EFR, TDM et IRM supérieur à 1 jour
Mots Clés
Bibliographie
- Brenner DJ, Hall EJ. Cancer risks from CT scans: now we have data, what next? Radiology. 2012 Nov;265(2):330–1.
- Pearce MS, Salotti JA, Little MP, McHugh K, Lee C, Kim KP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study. Lancet. 2012 Aug 4;380(9840):499–505.
- Grodzki DM, Jakob PM, Heismann B. Ultrashort echo time imaging using pointwise encoding time reduction with radial acquisition (PETRA). Magn Reson Med Off J Soc Magn Reson Med Soc Magn Reson Med. 2012 Feb;67(2):510–8.
Titre
Evaluation de l’efficacité de l’azithromycine dans la prévention du syndrome de bronchiolite oblitérante au décours de l’allogreffe de cellules souches hématopoïétiques
Acronyme : ALLOZITHRO ; Clinical Trial : NCT01959100Nom et prénom de l’investigateur-coordinateur
 Pr Anne BERGERON
Pr Anne BERGERON Promoteur
Direction de la Politique Médicale
Département de la Recherche Clinique et du Développement
Fadila Amerali
Chef de projet DRCD
DRCD - Hôpital Saint Louis
1, avenue Claude Vellefaux - 75010 Paris
Domaine de Recherche
Structure responsable de la gestion de projet
Site Saint Louis
1, avenue Claude Vellefaux - 75010 Paris
Rationnel
Hypothèse :
Originalité et Caractère Innovant
- Très peu d’études randomisées sont effectuées dans le domaine de la GVH pulmonaire : seules 2 sont actuellement enregistrées évaluant un traitement curatif de la bronchiolite oblitérante : l’azithromycine (Lam, Bone Marrow Transplant, 2011) et le budésonide/Formotérol (Bergeron, article soumis).
- 20 des 27 centres d’allogreffes de CSH adultes français participent à l’étude, ce qui témoigne de l’intérêt majeur porté à cette problématique.
- Compte tenu du fait qu’il n’existe pas à l’heure actuelle de marqueur pour prédire la survenue et la gravité du SBO dans le suivi des receveurs d’une allogreffe de CSH ni de traitement curatif, une approche prophylactique qui n’avait jamais été envisagée jusque-là est particulièrement novatrice.
- Le schéma de l’étude doit permettre de répondre à la question posée.
- Très peu d’équipes de pneumologues sont impliquées dans cette thématique de recherche. La vision pneumologique doit permettre une approche optimale.
Objet de la Recherche
Tous les patients consécutifs devant recevoir une allogreffe de CSH dans les centres participant à l’étude et qui remplissent les critères d’inclusion suivant :
- > 16 ans
- Indication de l’allogreffe de CSH pour une hémopathie maligne
- Explorations fonctionnelles respiratoires (EFR) pré-greffe
- Ayant signé un consentement éclairé
- Allergie ou intolérance à l’azithromycine, aux macrolides, ketolide ou leur Excipient
- Patients allergiques à la pénicilline et qui recevront une prophylaxie par macrolides (érythromycine, clarithromycine, roxithromycine, troléandomycine, azithromycine ou ketolide (télithromycine)
- Intervalle QT (QTc) prolongé (>450 msec)
- Prise de médicaments au long cours susceptibles d’allonger l’intervalle QTc
- Antécédent familial de QTc long
- Antécédent d’insuffisance cardiaque congestive
- Prise de colchicine
- Prise d’ergotamine ou de dyhydroergotamine en raison du risque d’ergotisme
- Insuffisance hépatique sévère
- Antécédent d’infection à mycobactérie atypique
Bénéfices attendus pour le patient et/ou pour la santé publique
Mots Clés
Bibliographie
- Barker AF, Bergeron A, Rom WN, Hertz MI. Obliterative bronchiolitis. N Engl J Med. 2014 May 8;370(19):1820-8.
- Bergeron A, Godet C, Chevret S, Lorillon G, Peffault de Latour R, de Revel T, Robin M, Ribaud P, Socié G, Tazi A. Bronchiolitis obliterans syndrome after allogeneic hematopoietic SCT: phenotypes and prognosis. Bone Marrow Transplant. 2013 Jun;48(6):819-24
- Chien JW, Martin PJ, Gooley TA, et al. Airflow obstruction after myeloablative allogeneic hematopoietic stem cell transplantation. Am J Respir Crit Care Med. 2003;168:208-214.
- Vos R, Vanaudenaerde BM, Verleden SE, et al. A randomised controlled trial of azithromycin to prevent chronic rejection after lung transplantation. Eur Respir J. 2011;37:164-172.
- Karine Chagnon, Frédéric Schlemmer, Véronique Meignin, Anne Bergeron. Pulmonary manifestations of haematological malignancies. Focus on pulmonary chronic graft versus host disease. 2014 ; Orphan Lung Diseases. Teresa Dudley, Associate Editor, Springer Clinical Medicine